雷公藤红素/丹参酮IIA磺酸钠共传递脂质体的制备、表征及协同抗乳腺癌研究
2018-12-26 16:33:22
雷公藤红素(celastrol,Cel)是来源于雷公藤根皮的三萜类化合物[1],是雷公藤的主要有效成分,具有抗炎[2]、抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡[3-5]等作用,被评选为21世纪较可能成药的5大天然药物之一[6].但由于其水溶性差、体内生物利用度不高以及安全性等问题,临床应用受到了较大的限制[7-8].脂质体(liposome)结构类似于细胞膜,具有增溶难溶性药物、靶向递药、促抗肿瘤药物减毒增效等优势,是抗肿瘤纳米剂型中商业化程度可高达的一种剂型[8-9],将Cel进行脂质体包封有望克服其理化性质带来的药用局限性.但是,临床研究表明,目前尚未有直接证据显示脂质体产品在抗肿瘤药效学上比普通制剂有显著优势,其原因可能与肿瘤血管异常化所致的药物瘤内递送障碍有关[10].
丹参酮IIA磺酸钠(sodium tanshinone IIA sulfonate,STS)是丹参中含有的脂溶性活性成分丹参酮IIA经磺化后得到的一种水溶性物质[11],具有良好的活血化瘀功效以及改善体内血管微循环的功能[12].本课题组前期研究表明,STS还能够对肿瘤畸形血管进行正常化,是一个潜在的肿瘤血管正常化调节剂,其机制与丹参酮IIA类似[13].因此,将STS和Cel共同装配至脂质体中,期望凭借STS的血管正常化作用,协同提高Cel脂质体的体内抗肿瘤疗效.本实验通过薄膜分散法[14]将肿瘤血管调节剂STS和中药抗肿瘤成分Cel共同包埋于脂质体中,通过对脂质体制备工艺探索和体外协同抗肿瘤评价等,确定工艺的可靠性和体外抗肿瘤的有效性,为后续体内研究建立扎实的实验基础.
1 仪器与材料
1.1 仪器
Nano-ZS马尔文粒径测定仪,英国马尔文公司,含动态光散射(DLS)系统;Agilent 1260高效液相色谱仪,美国Agilent公司;电子分析天平,百万分之一,瑞士Mettler-Toledo公司;Milli-Q纯水系统、RE-52A旋转蒸发仪,上海亚荣生化仪器厂;Guava easycyte 4L流式细胞仪,美国Millipore公司;IX73生物显微镜,日本Olympus公司;声波细胞粉碎机,南京先欧仪器制造有限公司;TG16W台式高速离心机,长沙湘智离心机仪器有限公司;HERA Cell 150iCO2培养箱、酶标仪,美国ThermoFisher Scientific公司;24孔培养板、96孔培养板,Corning公司.
1.2 材料
大豆卵磷脂,上海艾韦特医药科技有限公司,磷脂质量分数>50%;胆固醇,上海惠兴生化试剂有限公司,质量分数≥99%;Cel,郎泽医药科技有限公司,质量分数≥99%;STS,西安鸿生生物技术有限公司,质量分数≥98%;异硫氰酸荧光素(FITC),上海阿拉丁生化科技股份有限公司,质量分数≥99%;胎牛血清(FBS),以色列Biological Industries公司;DMEM培养基、胰蛋白酶溶液、磷酸盐缓冲液,上海源培生物科技股份有限公司;GuavaNexin Reagent细胞凋亡检测试剂盒、四甲基偶氮唑盐(MTT),南京凯基生物科技发展有限公司;甲醇为色谱纯;其他试剂均为分析纯;水为纯水.人源乳腺癌MCF-7细胞株购于上海细胞库.
2 方法与结果
2.1 Cel和STS体外抗肿瘤配比筛选
通过前期预试验对不同质量比的Cel+STS联合给药组进行比较,发现Cel和STS质量配比为1:1、2:5、1:5时,对MCF-7细胞抑制效果较好,因此选取这3个比例进行较优化配比探索.
2.1.1 试药配制
(1)Cel溶液:称取1.8mg Cel溶于1mL的DMSO中,得浓度为4.0mmol/L游离Cel溶液.
(2)STS溶液:称取1.6mg STS用1mL不完全培养基配制成浓度为4.0mmol/L游离STS溶液.
(3)Cel+STS混悬液:称取1.8mg Cel和1.8mg STS溶于1mL的DMSO中,得Cel与STS质量比为1:1,Cel浓度为4.0mmol/L的混悬液;称取1.8mg Cel和4.5mg STS溶于1mL的DMSO中,得Cel与STS质量比为2:5,Cel浓度为4.0mmol/L的混悬液;称取1.8mg Cel和9.0mg STS溶于1mL的DMSO中,得Cel与STS质量比为1:5,Cel浓度为4.0mmol/L的混悬液.
2.1.2 MTT实验[15]
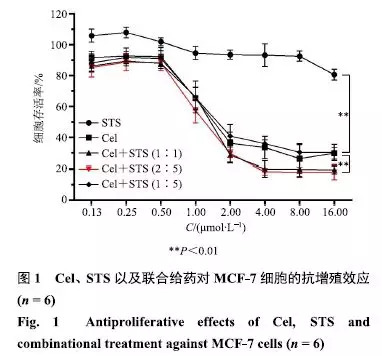
取对数生长期的MCF-7细胞,常规操作培养至细胞密度80%后,胰酶消化后离心,沉底细胞用含10%FBS的DMEM培养基稀释并吹散,细胞以1×105个/mL的密度接种于96孔板中,每孔加入100μL细胞悬液,置于37℃、5%CO2培养箱中孵育至细胞密度70%备用.对照组加DMEM不完全培养基;给药组分别加Cel混悬液、STS溶液和Cel+STS混悬液(1:1、2:5、1:5),Cel混悬液和Cel+STS混悬液组用不完全培养基稀释,以Cel浓度计为16.00、8.00、4.00、2.00、1.00、0.50、0.25、0.13μmol/L,STS溶液组用不完全培养基稀释,以STS浓度计为16.00、8.00、4.00、2.00、1.00、0.50、0.25、0.13μmol/L,每个浓度设6个复孔.药物与细胞共孵育48h后,每孔加入10μL MTT PBS溶液(5mg/mL),染色4h后,移除上层培养基,每孔加入150μL DMSO溶液,摇床低速振摇10min后,采用酶标仪检测490nm处各孔吸光度(A)值.计算细胞存活率、细胞增殖抑制率,再根据增殖抑制率计算细胞增殖的半数抑制浓度(IC50)和2种药物的协同指数(CI).IC50的计算采用Graphpad Prism 6.0软件,其他计算公式如下.结果见图1和表1.
细胞存活率=A给药/A对照
细胞增殖抑制率=1-A给药/A对照
CI=IC50a/IC50A+IC50b/IC50B
IC50a、IC50b分别表示给药组中各组分的IC50,IC50A、IC50B分别表示相应对照组的IC50
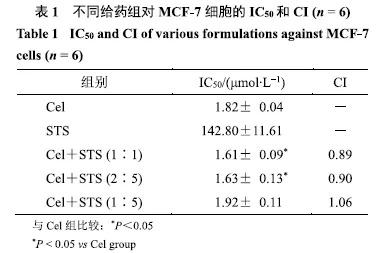
由图1可知,STS(<16μmol/L)对MCF-7细胞无明显抗增殖活性;但Cel(>0.5μmol/L)对MCF-7细胞增殖有明显抑制作用,并且在0.5~2.0μmol/L呈浓度依赖性;不同质量配比的Cel和STS联合给药表现出与Cel相当以及增强的抗MCF-7细胞增殖能力.从表1可知,质量比为2:5和1:1时对MCF-7细胞的IC50分别为(1.63±0.13)μmol/L和(1.61±0.09)μmol/L,CI分别为0.90和0.89,相较于单药治疗组,表现出明显的协同效应.考虑到后续工作中需要保证STS具有较高的治疗浓度,因此将两药配比设定为2:5.
 |
 |
2.2 Cel/STS共传递脂质体(Cel/STS-CL)制备及表征
脂质体包封2种极性差异较大的药物,包封率也有明显差异.为了调控Cel/STS-CL中所包埋的2组分有效质量比为1:1、2:5、1:5,前期对单组分脂质体进行多批次的工艺摸索,在稳定各组分的包封率后,通过理论计算和大量实验优化,较终将2组分的投药比确定为3:4、1:3、1:9时,实际被包封的2组分配比符合实验要求.
2.2.1 薄膜分散法制备脂质体
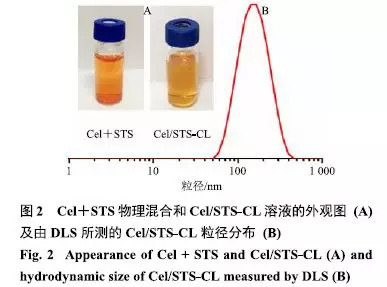
(1)Cel/STS-CL制备:称取大豆卵磷脂60.0mg、胆固醇15.0mg与一定量的Cel混溶于10mL氯仿中,于37℃下100r/min恒温水浴减压蒸除有机溶剂,直至瓶壁形成均匀薄膜,真空干燥过夜除去残留有机试剂.加入一定浓度的STS溶液10mL,于37℃下100r/min恒温水浴常压水合1h后,冰浴声10min(功率250W),流动水透析4h后过0.45、0.22μm微孔滤膜滤过,得到澄清透亮的脂质体溶液(图2-A).两药物理混合后有明显的不溶物,脂质体溶液则体系均一、澄清透明、略带乳光.
 |
为考察双组分共传递脂质体在协同抗肿瘤方面的优势,本研究还通过类似的制备方法构建相应的单组分脂质体,作为对照.
STS脂质体(STS-Lip)制备:称取大豆卵磷脂60.0mg、胆固醇15.0mg溶于10mL氯仿中,于37℃下100r/min恒温水浴减压蒸除有机溶剂,直至瓶壁形成均匀薄膜,真空干燥过夜除去残留有机试剂.加入1.0mg/mL的STS溶液10mL,于37℃下100r/min恒温水浴常压水合1h后,冰浴声10min(功率250W),流动水透析4h后除去未包封的STS,较后过0.45μm微孔滤膜得到澄清透亮的脂质体溶液.
Cel脂质体(Cel-Lip):称取大豆卵磷脂60.0mg、胆固醇15.0mg和Cel 3.0mg混溶于10mL氯仿中,于37℃下100 r/min恒温水浴减压蒸除有机溶剂,直至瓶壁形成均匀薄膜,真空干燥过夜除去残留有机试剂.加入纯水10mL,于37℃下100r/min恒温水浴常压水合1h后,冰浴声10min(功率250W),分别过0.45、0.22μm微孔滤膜滤过以去除未包封的Cel,得到澄清透亮的脂质体溶液.
2.2.2 脂质体表征
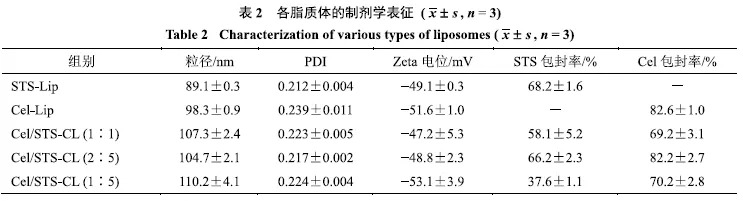
通过动态光散射(DLS)粒径仪测得基本的制剂学参数.由表2可知,STS-Lip和Cel-Lip的平均粒径分别为(89.1±0.3)nm和(98.3±0.9)nm,表明水难溶性药物被包封至较薄的双分子层后粒径会有小幅增加;当同时包埋双组分后,Cel/STS-CL粒径根据实际包封药物组分配比不同(1:1、2:5、1:5)分别为(107.3±2.4)、(104.7±2.1)、(110.2±4.1)nm,组间无显著性差异,但与单药脂质体相比粒径显著升高.由图2-B所示,所制得的Cel/STS-CL粒径分布较小,结合DLS数据可知,各制剂的多分散指数(PDI)均处于0.21左右.此外,各脂质体的表面电位均处于−50mV左右,这种高负电性可能与大豆卵磷脂的物化性质有关.
 |
通过透射电镜(TEM)观察粒子的形态学特征.于Formvar支持膜的铜网上滴加1滴Cel/STS-CL溶液,滤纸小心吸除多余液体后,立即滴加20μL 1%的磷钨酸溶液,室温下风干30min,立即置于TEM下观察脂质体的外观形态.如图3所示,Cel/STS-CL脂质体形态成近圆形,外观圆整,双分子层清晰可见,粒径约为100nm,结果与DLS数据基本一致.
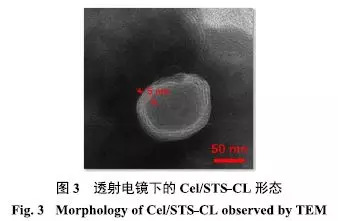 |
2.3 脂质体包封率考察
2.3.1 色谱条件[16]
(1)Cel的HPLC测定条件:采用Agilent SB-C18色谱柱(150mm×4.6mm,5μm);柱温30℃;流动相为甲醇-2%醋酸水溶液(90:10);体积流量1mL/min;检测波长426nm;进样量10μL.
(2)STS的HPLC测定条件:采用Agilent SB-C18色谱柱(150mm×4.6mm,5μm);柱温30℃;流动相为甲醇-2%醋酸水溶液(70:30);体积流量1mL/min;检测波长271nm;进样量10μL.
2.3.2 标准曲线的绘制
精密称取Cel 2.5mg,用甲醇稀释成质量浓度分别为1.9、3.9、7.8、15.6、31.2、62.5μg/mL溶液;精密称取STS 2.0mg,用甲醇稀释成质量浓度分别为3.1、6.3、12.5、25.0、50.0、100.0μg/mL溶液,于上述色谱条件下分别测定峰面积.以峰面积(Y)与质量浓度做线性回归,得Cel和STS的回归方程分别为Cel Y=16.332C+1.7724,r2=0.9999;STS Y=17.102C-18.345,r2=0.9997,分别在1.9~62.5μg/mL及3.1~100.0μg/mL线性关系良好.
2.3.3 包封率测定
取透析过膜后的脂质体溶液1.0mL,加9倍量甲醇破乳后,HPLC测定Cel和STS的含量.计算二者包封率(包封率=W包/W总,其中W包和W总分别表示脂质体包载量和总投料量),结果见表2.
由表2可知,薄膜分散法制备的脂质体对亲水性的STS包封率约为68%,而对亲脂性的Cel包封率则为82%左右.不同质量配比的双组分共传递脂质体对两药的包封率与单组分对照组有显著差异,其中以被包封药物的质量配比2:5组包封率可高达.值得注意地是,该投料比工艺下制备的脂质体各组分包封率较接近单组分脂质体组.这不仅从制剂学角度验证了Cel和STS质量比为2:5时适合脂质体给药系统的装配,也为制备组分可控的双组分共传递脂质体提供了实验基础.
2.4 体外抗肿瘤活性研究
2.4.1 试药配制
游离药物的配制同“2.1.1”项方法,Cel-Lip制备同“2.2.1”项方法.Cel/STS-CL的制备:称取大豆卵磷脂60.0mg,胆固醇15.0mg与Cel 1.0mg混溶于10mL氯仿中,于37℃下100r/min恒温水浴减压蒸除有机溶剂,直至瓶壁形成均匀薄膜,真空干燥过夜除去残留有机试剂.加入0.3mg/mL的STS溶液10mL,于37℃下100r/min恒温水浴常压水合1h后,冰浴声10min(功率250W),流动水透析4h后过0.45、0.22μm微孔滤膜滤过,得到澄清透亮的脂质体溶液.
2.4.2 MTT实验
给药组分别给予Cel+STS(2:5)、Cel-Lip和Cel/STS-CL,其余方法同“2.1.2”项,结果见表3、4.
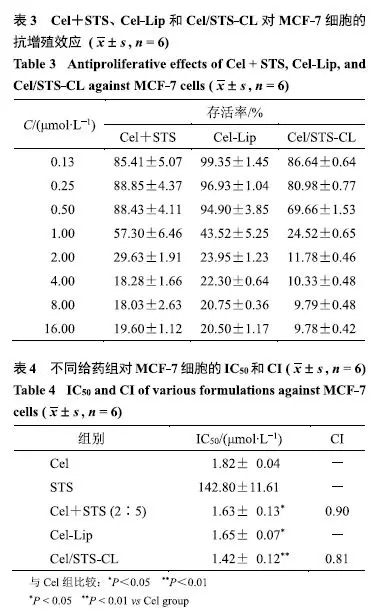 |
由表3可知,Cel+STS、Cel-Lip、Cel/STS-CL对MCF-7细胞增殖均有明显的抑制作用,并且与Cel浓度呈正相关.Cel/STS-CL组抗细胞增殖能力显著高于单组分脂质体,表明两药联用具有更高的抑制细胞增殖能力.从表4可知,Cel-Lip组和Cel/STS-CL组IC50值分别为(1.65±0.07)μmol/L和(1.42±0.12)μmol/L,相较于游离单药组,抑制细胞增殖能力明显增强.Cel/STS-CL组CI值为0.81,相较于游离双药组,表现出更显著的协同效应.
2.5 细胞摄取研究
2.5.1 试药配制
游离FITC溶液(FITC):精密称取1.0mg FITC,用无水乙醇溶解定容至5mL,得500μmol/L游离FITC溶液,4℃避光保存.
FITC与STS、Cel混合液(FITC+STS+Cel):精密称取FITC 1.0mg,STS 5.0mg,Cel 2.0mg避光条件下,混合均匀,溶于5mL DMSO中,4℃避光保存.
薄膜分散法制备FITC脂质体(FITC-Lip)和FITC-丹参酮IIA磺酸钠-雷公藤红素脂质体(FITC/Cel/STS-CL),方法同“2.4.1”项.
2.5.2 细胞摄取实验
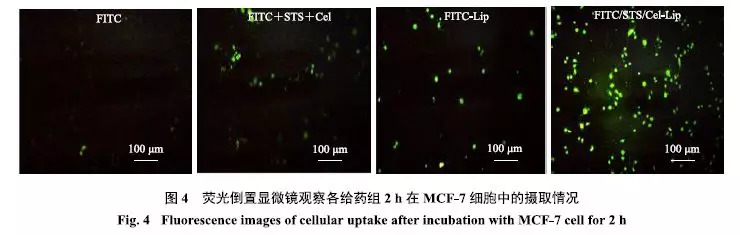
收集对数生长期MCF-7细胞,用胰蛋白酶消化,用10%胎牛血清的DMEM完全培养基重悬成单细胞悬液,用含10%胎牛血清的DMEM完全培养基稀释至细胞5×104个/mL,接种于24孔细胞培养板,每孔培养液400μL,培养24h后,吸弃孔内原培养液,分别将FITC、FITC+ STS+Cel、FITC-Lip、FITC/STS/Cel-Lip用不完全培养基稀释为FITC终浓度5 μmol/L的溶液,给药于MCF-7细胞,每孔400μL,并设置空白对照组.继续孵育2h,吸除24孔中含有药物的培养基,用冰冷PBS反复清洗3次后,于荧光倒置显微镜下观察并比较各孔的荧光信号,结果见图4;并借助流式细胞仪定量考察细胞内荧光摄取情况,结果见表5.
 |
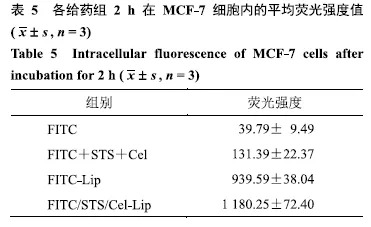 |
如图4所示,FITC+STS+Cel组细胞内荧光强度强于游离FITC组,提示双组分中可能有促进细胞摄取的成分,这可能与STS能够抑制耐药外排泵有关[17];FITC-Lip组细胞内荧光强度强于游离FITC组,展现出纳米制剂强大的促细胞摄取能力;较重要地是,FITC/Cel/STS-CL组荧光强度较强,从细胞摄取角度进一步验证了双组分共传递脂质体的优势.表5中给药后各制剂组细胞内荧光强度值趋势与荧光图像一致.
2.6 细胞凋亡研究
2.6.1 试药配制
Cel溶液:称取1mg Cel溶于1mL的DMSO中,得质量浓度为1mg/mL游离Cel溶液.Cel+STS混悬液:称取1mg Cel和2.5mg STS溶于1mL的DMSO中,得Cel与STS质量比为2:5,Cel质量浓度为1mg/mL的混悬液.Cel-Lip和Cel/STS-CL的制备同“2.4.1”项方法.
2.6.2 细胞凋亡实验
收集对数生长期MCF-7细胞,用胰蛋白酶消化,用10%胎牛血清的DMEM完全培养基重悬成单细胞悬液,用含10%胎牛血清的DMEM完全培养基稀释至细胞5×104个/mL,接种于24孔细胞培养板,每孔培养液400μL,培养24h后,吸弃孔内原培养液,将Cel、Cel+STS、Cel-Lip、Cel/STS-CL分别用不完全培养基稀释至不同质量浓度(以Cel质量浓度计,分别为0.5、1.0、2.0、5.0μg/mL),每孔500μL.然后移入细胞培养箱中继续培养4h.培养孵育结束后,吸去培养基,用冰冷的PBS反复清洗3次终止反应,每孔加入100μL不含有EDTA的胰酶消化液,放入细胞培养箱中继续孵育2min,待细胞边缘变亮,迅速弃除消化液,加入含有10%胎牛血清的PBS缓冲液终止消化,将孔内的细胞吹打下来,1000r/min离心5 min,弃除上清液后取100μL细胞加入96孔板,1:1加入100μL细胞凋亡检测试剂Guava Nexin Reagent,避光孵育20min,采用流式细胞仪测定MCF-7细胞的凋亡情况,结果见图5.
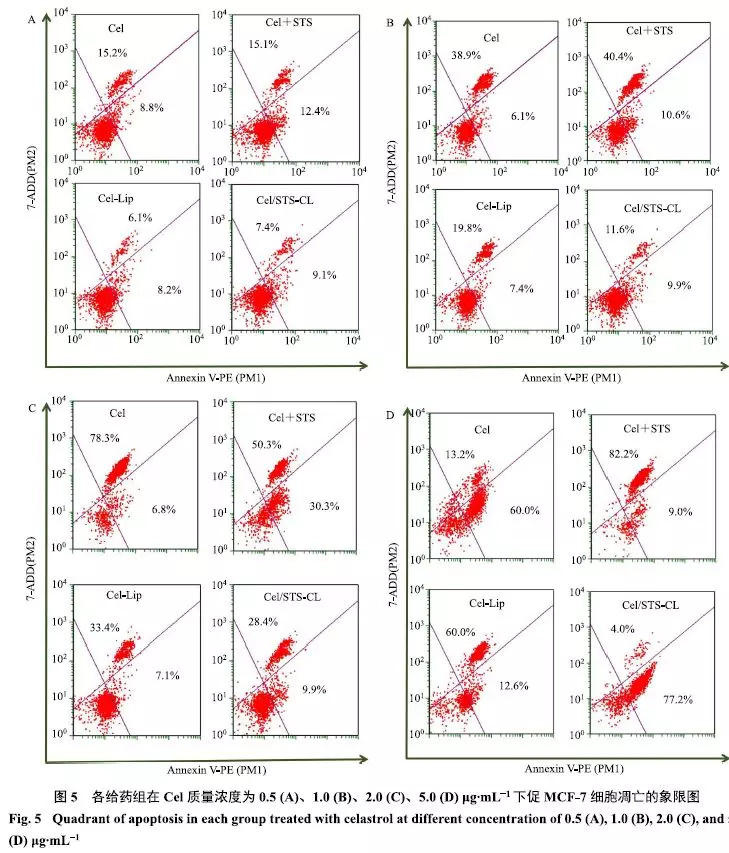 |
如图5所示,各给药组诱导MCF-7细胞凋亡的能力随着Cel质量浓度的增加而提高.但值得注意的是,各质量浓度下脂质体组诱导细胞凋亡比率都低于相应的Cel裸药组,可能是因为孵育时间较短,脂质体具有缓释作用使得药物无法从中较快释放,因此裸药组细胞凋亡更多.在Cel<5.0μg/mL时,脂质体组的细胞凋亡率不足50%,当Cel为5.0μg/mL时,Cel-Lip组和Cel/STS-CL组的细胞凋亡率分别达到70%和80%,此时脂质体组才显示出明显的促细胞凋亡作用,提示细胞凋亡可能与药物的孵育浓度以及释药速率等因素有关.
3 讨论
脂质体是一种可以同时包埋难溶性成分和水溶性成分的纳米剂型[17],但是采用同一种制备方法包埋极性差异较大的双组分,通常会遇到包封率不高的问题.本研究在以往工作的基础上,选用Cel和STS作为联用药物,仅通过薄膜分散法即可制备出双组分包封率均较高的共传递脂质体,这可能与双组分的油水分配系数均在适合脂质体包埋的范围内有关[18].如何实现双组分共传递脂质体携带有效药物质量配比的调控也是研究工作的难点.本研究首先借助MTT细胞毒实验确定了两组分体外抗肿瘤的较佳质量配比,在此基础上进行制备工艺摸索,较后得到的制备工艺能够携带较佳质量比例的双组分,且制剂学(粒径、电位、多分散系数)和形态学行为均适合进行后续研究.
具有协同抗肿瘤效应的双组分装配成一个递药系统后,协同效率会受到粒子稳定性、药物释放速率、细胞/器官摄取以及体内靶向等因素的影响[19].因此,验证共传递脂质体化的Cel和STS的协同抗肿瘤效应也是本研究的重点内容.在以MCF-7细胞为模型的细胞学实验中,Cel/STS-CL对MCF-7细胞的抗增殖能力明显强于物理混合组和Cel裸药组,表明这种双组分共传递脂质体不仅重现了物理混合双组分的协同效应[20],还在此基础上又进一步的优化,这与脂质体被MCF-7细胞内化的能力强于其对照组有关.此外,考虑到物理混合的双组分进入细胞的能力差异,胞内两种药物有效浓度可能会与投药量有所偏差,Cel/STS-CL由于具备共传递的特性,亲水性和亲油性药物可以同时进入细胞,因此更有利于优化协同抗肿瘤效率.在细胞摄取和实验中,脂质体表现出纳米制剂独特的细胞内化能力[21],这也是Cel/STS-CL体外抗肿瘤作用得到改善的重要原因.值得注意的是,细胞凋亡诱导结果似乎并没有显示出双组分共传递的优势,这可能与药物作用时间、药物从脂质体中释放速率等有关.
本研究通过简单的制备工艺,得到性质稳定、形态圆整、组分配比可控的双组分共传递脂质体,并通过一系列体外细胞学实验,验证了双组分共传递脂质体协同抗肿瘤的优势.后续工作将聚焦于其体内吸收、分布、抗肿瘤药效评价等,进一步验证设计思路的科学性和有效性.
" 巡山"上传

















